公司地址:
河北省石家庄市高邑县千秋路
版权所有:河北诚泽化工设备有限公司 冀ICP备18023413号-1 网站建设:中企动力 石家庄 冀公网安备13012702000130号
公司传真:
0311-85837070
联系电话:
0311- 83951911
河北诚泽化工设备有限公司
公司邮箱:
新闻中心
重结晶经验总结
重结晶经验总结
1、原理:
固体有机物在溶剂中的溶解度与温度有密切关系。一般是温度升高,溶解度增大。若把固体溶解在热的溶剂中达到饱和,冷却时即由于溶解度降低,溶液变成过饱和而析出晶体。利用溶剂对被提纯物质及杂质的溶解度不同,可以使被提纯物质从过饱和溶液中析出。而让杂质全部或大部分仍留在溶液中(若在溶剂中的溶解度极小,则配成饱和溶液后被过滤除去),从而达到提纯目的。
2、选择溶剂的条件:
(1)不与被提纯物质起化学反应,例如脂肪族卤代烃类化合物不宜用作碱性化合物结晶和重结晶的溶剂;醇类化合物不宜用作酯类化合物结晶和重结晶的溶剂,也不宜用作氨基酸盐酸盐结晶和重结晶的溶剂。
(2)选择的溶剂对欲纯化的化学试剂在热时应具有较大的溶解能力,而在较低温度时对欲纯化的化学试剂的溶解能力大大减小。
(3)对杂质的溶解非常大或者非常小(前一种情况是使杂质留在母液中不随被提纯物晶体一同析出;后一种情况是使杂质在热过滤时被滤去)
(4)选择的溶剂沸点不宜太高,以免该溶剂在结晶和重结晶时附着在晶体表面不容易除尽。用于结晶和重结晶的常用溶剂有:水、甲醇、乙醇、异丙醇、丙酮、乙酸乙酯、氯仿、冰醋酸、二氧六环、四氯化碳、苯、石油醚等。此外,甲苯、硝基甲烷、乙醚、二甲基甲酰胺、二甲亚砜等也常使用。二甲基甲酰胺和二甲亚砜的溶解能力大,当找不到其它适用的溶剂时,可以试用。但往往不易从溶剂中析出结晶,且沸点较高,晶体上吸附的溶剂不易除去,是其缺点。乙醚虽是常用的溶剂,但是若有其它适用的溶剂时,最好不用乙醚,因为一方面由于乙醚易燃、易爆,使用时危险性特别大,应特别小心;另一方面由于乙醚易沿壁爬行挥发而使欲纯化的化学试剂在瓶壁上析出,以致影响结晶的纯度。更强的溶剂,如甲醇、水等,应实验极性较小的溶剂,如丙酮、二氧六环、苯、石油醚等。适用溶剂的最终选择,只能用试验的方法来决定。若不能选择出一种单一的溶剂对欲纯化的化学试剂进行结晶和重结晶,则可应用混合溶剂。混合溶剂一般是由两种可以以任何比例互溶的溶剂组成,其中一种溶剂较易溶解欲纯化的化学试剂,另一种溶剂较难溶解欲纯化的化学试剂。一般常用的混合溶剂有:乙醇和水、乙醇和乙醚、乙醇和丙酮、乙醇和氯仿、二氧六环和水、乙醚和石油醚、氯仿和石油醚等等,最佳复合溶剂的选择必须通过预试验来确定。
(5)能给出较好的晶体
(6)无毒或毒性很小,便于操作
另外,尽可能选择单一溶剂,这样在大生产时也可较好的解决母液回收套用问题,降低成本。研究时,混合溶剂一般会有更好效果。还有安全,价廉也是考虑因素。

3、溶解
通过试验结果或查阅溶解度数据计算被提取物所需溶剂的量,在将被提取物晶体置于锥形瓶中,加入较需要量稍少的适宜溶剂,加热到微微沸腾一段时间后,若未完全溶解,可再添加溶剂,每次加溶剂后需再加热使溶液沸腾,直至被提取物晶体完全溶解(但应注意,在补加溶剂后,发现未溶解固体不减少,应考虑是不溶性杂质,此时就不要再补加溶剂,以免溶剂过量)。
注意事项:
(1)溶剂量的多少,因同时考虑两个因素。容极少则收率高,但可能给热过滤带来麻烦,并可能造成更大的损失;容极多,显然会影响回收率。故两者应综合考虑。一般可比需要量多加20%左右的溶剂(有人认为一般可比需要量多20—100%的溶剂)。
(2)可以在溶剂沸点温度时溶解固体,但必须注意实际操作温度是多少,否则会因实际操作时,被提纯物晶体大量析出。但对某些晶体析出不敏感的被提纯物,可考虑在溶剂沸点时溶解成饱和溶液,故因具体情况决定,不能一概而论。例如,本次实验在100℃时配成饱和溶液,而热过滤操作温度不可能是100℃,可能是80℃?也可能是90℃?那么在考虑加多少溶剂时,应同时考虑热过滤的实际操作温度。
(3)为了避免溶剂挥发及可燃性溶剂着火或有毒溶剂中毒,应在锥形瓶上装置回流冷凝管,添加溶剂可从冷凝管的上端加入。
(4)若溶液中含有色杂质,则应加活性炭脱色,应特别注意活性炭的使用。
4、乘热过滤
(1)若为易燃溶剂,则应防止着火或防止溶剂挥发。
(2)应注意滤纸的折叠方法及操作要领(包括漏斗的预热、滤纸的热水润湿等);应洗净抽滤瓶,注意和滤纸的大小、滤纸的人润湿等操作,开始不要减压太甚,以免将滤纸抽破(在热溶剂中,滤纸强度大大下降)。
5、结晶
(1)将滤液在室温或保温下静置使之缓缓冷却(如滤液已析出晶体,可加热使之溶解),析出晶体,再用冷水充分冷却。必要时,可进一步用冰水或冰盐水等冷却(视具体情况而定,若使用的溶剂在冰水或冰盐水中能析出结晶,就不能采用此步骤)。
(2)有时由于滤液中有焦油状物质或胶状物存在,使结晶不易析出,或有时因形成过饱和溶液也不析出晶体,在这种情况下,可用玻棒摩擦器壁以形成粗糙面,使溶质分子成定向排列而形成结晶的过程较在平滑面上迅速和容易;或者投入晶种(同一物资的晶体,若无此物质的晶体,可用玻棒蘸一些溶液稍干后即会析出晶体),供给定型晶核,使晶体迅速形成。加晶种的时机:晶种加得过早,晶种溶解或产生的晶型一般较细;加的晚,则溶液里可能已经产生了晶核,造成结晶可能包裹杂质。
(3)有时被提纯化合物呈油状析出,虽然该油状物经长时间静置或足够冷却后也可固化,但这样的固体往往含有较多的杂质(杂质在油状物中常较在溶剂中的溶解度大;其次,析出的固体中还包含一部分母液),纯度不高。用大量溶剂稀释,虽可防止油状物生成,但将使产物大量损失。这时可将析出油状物的溶液重新加热溶解,然后慢慢冷却。一当油状物析出时便剧烈搅拌混合物,使油状物在均匀分散的状况下固化,但最好是重新选择溶剂,使其得到晶形产物。

6、抽气过滤(减压过滤)
(1)装置中各仪器的名称和用途介绍。
(2)减压过滤程序介绍:剪裁合符规格的滤纸放入漏斗中→用少量溶剂润湿滤纸→开启水泵并关闭安全瓶上的活塞,将滤纸吸紧→打开安全瓶上的活塞,再关闭水泵→借助玻棒,将待分离物分批倒入漏斗中,并用少量滤液洗出粘附在容器上的晶体,一并倒入漏斗中→再次开启水泵并关闭安全瓶上的活塞进行减压过滤直至漏斗颈口无液滴为止→打开安全瓶上的活塞,再关闭水泵→用少量溶剂润湿晶体→再次开启水泵并关闭安全瓶上的活塞进行减压过滤直至漏斗颈口无液滴为止(必要时可用玻塞挤压晶体,此操作一般进行1—2次)。如重结晶溶剂沸点较高,在用原溶剂至少洗涤一次后,可用低沸点的溶剂洗涤,使最后的结晶产物易于干燥(要注意该溶剂必须是能和第一种溶剂互溶而对晶体是不容或微溶的)。抽滤所得母液若有用,可移至其它容器内,再作回收溶剂及纯度较低的产物。
7、结晶的干燥和纯度判定
在测定熔点前,晶体必须充分干燥,否则测定的熔点会偏低。固体干燥的方法很多,要根据重结晶所用溶剂及结晶的性质来选择。
(1)空气凉干(不吸潮的低熔点物质在空气中干燥是最简单的干燥方法)。
(2)烘干(对空气和温度稳定的物质可在烘箱中干燥,烘箱温度应比被干燥物质的熔点低20—50℃。
(3)用滤纸吸干(此方法易将滤纸纤维污染到固体物上)
(4)置于干燥器中干燥
结晶的纯度判定都是一般的常规方法。不过某些产品作的多了,可以凭经验的,如该样品经过多次重结晶后,看到应该出现的那种晶型,根据以往检测结果,其含量应该八九不离十了,不确定的可以用HPLC测定。判定结晶纯度的方法:理化性质均一;固体化合物熔距≤ 2℃;TLC或PC展开呈单一斑点;HPLC或GC分析呈单峰。
二、重结晶经验总结
结晶过程涉及气体、液体或溶液相中的离子、原子或分子有序的进入固态中有规则的位置。初始阶段是形成晶核,接着的是在晶面上的沉积,后者可被考虑为流体与晶体间的动力学平衡,当向前速度占支配地位时,晶体就生长,影响平衡的因素:包括晶体表面的化学性质,被结晶物质的浓度,晶体内和晶体周围介质的性质。晶体的形成是发生在出现临界大小的晶核以后,此时生成自由能由正值,零变为负值。成核速率随过饱和度显著增加,为了限制晶核数量,过饱和度应尽可能的低,过饱和应慢慢到达,一旦到达这种低程度的过饱和以后,就要小心控制,使少数几颗晶核在准平衡状态下,慢慢生长。
在成核过程中,外部物体,诸如灰尘颗粒,往使得成核过程热力学上更有利,所以这些颗粒要通过离心分离或过滤的方法事先去除。加晶种方法也常是控制晶核数量一种方法。溶剂的选择(单一或复合)、结晶温度,搅拌速度,搅拌方式,过饱和度的选择,养晶的时间,溶媒滴加的方式和速率等等,另外,在溶解、析晶、养晶这些过程中,上述温度、搅拌速度、时间多少、加入方式和速度还不完全一样。所以诸多因素叠加在一起,更是觉得难度大。
一般说来,先应该选择主要的条件,使结晶过程能够进行下去,得到晶体,然后再优化上述条件。条件成熟后,才能进行中试和生产。
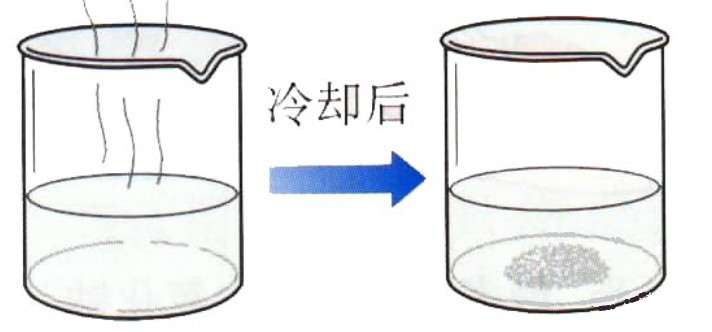
结晶和重结晶包括以下几个主要操作步骤:
1.将需要纯化的化学试剂溶解于沸腾或将进沸腾的适宜溶剂中;
2.将热溶液趁热抽滤,以除去不溶的杂质;
3.将滤液冷却,使结晶析出;
4.滤出结晶,必要时用适宜的溶剂洗涤结晶。
在实施结晶和重结晶的操作时要注意以下几个问题;
1.在溶解预纯化的化学试剂时要严格遵守实验室安全操作规程,加热易燃、易爆溶剂时,应在没有明火的环境中操作,并应避免直接加热。因为在通常的情况下,溶解度曲线在接近溶剂沸点时陡峭地升高,故在结晶和重结晶时应将溶剂加热到沸点。为使结晶和重结晶地收率高,溶剂的量尽可能少,故在开始加入的溶剂量不足以将欲纯化的化学试剂全部溶解,在加热的过程中可以小心的补加溶剂,直到沸腾时固体物质全部溶解为止。补加溶剂时要注意,溶液如被冷却到其沸点以下,防爆沸石就不在有效,需要添加新的沸石。
2.为了定量地评价结晶和重结晶地操作,以及为了便于重复,固体和溶剂都应予以称量和计量。
3.在使用混合溶剂进行结晶和重结晶时,最好将欲纯化的化学试剂溶于少量溶解度较大的溶剂中,然后趁热慢慢地分小份加入溶解度较小的第二种溶剂,直到它触及溶液的部位有沉淀生成但旋即有溶解为止。如果溶液的总体积太小,则可多加一些溶解度大的溶剂,然后重复以上操作。有时也可用相反的程序,将欲纯化的化学试剂悬浮于溶解度小的溶剂中,慢慢加入溶解度大的溶剂,直至溶解,然后再滴入少许溶解度小的溶剂加以冷却。
4.如有必要可在欲纯化的化学试剂溶解后加入活性炭进行脱色(用量约相当于欲纯化的物质重量的1/50~1/20),或加入滤纸浆、硅藻土等使溶液澄清。加入脱色剂之前要先将溶剂稍微冷却,因为加入的脱色剂可能会自动引发原先抑制的沸腾,从而发生激烈的、爆炸性的暴沸。活性碳内含有大量的空气,故能产生泡沫。加入活性碳后可煮沸5-10分钟,然后趁热抽滤去活性碳。在非极性溶剂,如苯、石油醚中活性碳脱色效果不好,可试用其他办法,如用氧化铝吸附脱色等。
5.欲纯化的化学试剂为有机试剂时,形成过饱和溶液的倾向很大,要避免这种现象,可加入同种试剂或类质同晶物的晶种。用玻璃棒摩擦器壁也能形成晶核,此后晶体即沿此核心生长。
6.结晶的速度有时很慢,冷溶液的结晶有时要数小时才能完全。在某些情况下数星期或数月后还会有晶体继续析出,所以不应过早将母液弃去。
7.为了降低欲纯化试剂在溶液中的溶解度,以便析出更多的结晶,提高产率,往往对溶液采取冷冻的方法。可以放入冰箱中或用冰、混合制冷剂冷却。
8.制备好的热溶液必须经过过滤,以除去不溶性的杂质,而且必须避免在抽滤的过程中在过滤器上结晶出来。若是一切操作正规,确实由于该试剂太易析出结晶而阻碍抽滤时,则可将溶液配制地稍微稀一些,或者采用保温或加热过滤装置(如保温漏斗)过滤。
9.欲使析出地晶体于母液有效地分离,一般用布氏漏斗抽滤。为了更好地使晶体和母液分离,最好用清洁地玻璃塞将晶体在布氏漏斗上挤压,并随同抽气尽量地去除母液。晶体表面地母液,可用尽量少地溶剂来洗涤。这是应暂时停止抽气,用玻璃棒或不锈钢刀将已压紧地晶体挑松,加入少量地溶剂润湿,稍待片刻,使晶体能均匀地被浸透,然后再抽干,这样重复一、二次,使附于浸透表面地母液全部除去为止。
10.晶体若遇热不分解时,可采用在烘箱中加热烘干的方法干燥。若晶体遇热易分解,则应注意烘箱的温度不能过高,或放在真空干燥器中在室温下干燥。若用沸点较高的溶剂重结晶时,应用沸点低的且对晶体溶解度很小的溶剂洗涤,以利于干燥。易潮解的晶体应将烘箱欲先加热到一定的温度,然后将晶体放入;但是极易潮解的晶体,往往不能用烘箱烘,必须迅速放入到真空干燥器中干燥。用易燃的有机溶剂重结晶的晶体在送入烘箱前,应预先在空气中干燥,否则可能引起溶剂的燃烧或爆炸。
11.小量及微量的物质的重结晶:小量的物质的结晶或重结晶基本要求同前所述,但均采用与该物质的量相适应的小容器。微量物质的结晶和重结晶可在小的离心管中进行。热溶液制备后立即离心,使不容的杂质沉于管底,用吸管将上层清夜移至到另一个小的离心管中,令其结晶。结晶后,用离心的方法使晶体和母液分离。同时可在离心管中用小量的溶剂洗涤晶体,用离心的方法将溶剂与晶体分离。
12.母液中常含有一定数量的所需要的物质,要注意回收。如将溶剂除去一部分后再让其冷却使结晶析出,通常其纯度不如第一次析出来的晶体。若经纯度检查不合要求,可用新鲜溶剂结晶,直至符合纯度要求为止。
三、重结晶问题与案例
1、重结晶法一般包括哪几个步骤?各步骤的主要目的如何?
答:一般包括:(1)选择适宜溶剂,制成热的饱和溶液。(2)热过滤,除去不溶性杂质(包括脱色)。(3)抽滤、冷却结晶,除去母液。(4)洗涤干燥,除去附着母液和溶剂。
2、重结晶时,溶剂的用量为什么不能过量太多,也不能过少?正确的应该如何?
答:过量太多,不能形成热饱和溶液,冷却时析不出结晶或结晶太少。过少,有部分待结晶的物质热溶时未溶解,热过滤时和不溶性杂质一起留在滤纸上,造成损失。考虑到热过滤时,有部分溶剂被蒸发损失掉,使部分晶体析出留在波纸上或漏斗颈中造成结晶损失,所以适宜用量是制成热的饱和溶液后,再多加20%左右。
3、用活性炭脱色为什单要待固体物质完全溶解后才加入?为什么不能在溶液沸腾时加入?
答:活性炭可吸附有色杂质、树脂状物质以及均匀分散的物质。因为有色杂质虽可溶于沸腾的溶剂中,但当冷却析出结晶体时,部分杂质又会被结晶吸附,使得产物带色。所以用活性炭脱色要待固体物质完全溶解后才加入,并煮沸5-10min。要注意活性炭不能加入已沸腾的溶液中,以一免溶液暴沸而从容器中冲出。
4、使用有机溶剂重结晶时,哪些操作容易着火?怎样才能避免呢?
答:有机溶剂往往不是易燃就是有一定的毒性,也有两者兼有的,操作时要熄灭邻近的一切明火,最好在通风橱内操作。常用三角烧瓶或圆底烧瓶作容器,因为它们瓶口较窄,溶剂不易发,又便于摇动,促使固体物质溶解。若使用的溶剂是低沸点易燃的,严禁在石棉网上直接加热,必须装上回流冷凝管,并根据其沸点的高低,选用热浴,若固体物质在溶剂中溶解速度较慢,需要较长时问,也要装上回流冷凝管,以免溶剂损失。
5、用水重结晶乙酰苯胺,在溶解过程中有无油状物出现?这是什么?
答:在溶解过程中会出现油状物,此油状物不是杂质。乙酰苯胺的熔点为114℃,但当乙酰苯胺用水重结晶时,往往于83℃就熔化成液体,这时在水层有溶解的乙酰苯胺,在熔化的乙酰苯胺层中含有水,故油状物为未溶于水而已熔化的乙酰苯胺,所以应继续加入溶剂,直至完全溶解。
6、使用布氏漏斗过滤时,如果滤纸大于漏斗瓷孔面时,有什么不好?
答:如果滤纸大于漏斗瓷孔面时,滤纸将会折边,那样滤液在抽滤时将会自滤纸边沿吸入瓶中,而造成晶体损失。所以不能大,只要盖住瓷孔即可。
7、停止抽滤前,如不先拔除橡皮管就关住水阀(泵)会有什么问题产生?
答:如不先拔除橡皮管就关水泵,会发生水倒吸入抽滤瓶内,若需要的是滤液问题就大了。
8、某一有机化合物进行重结晶,最适合的溶剂应该具有哪些性质?
答:(1)与被提纯的有机化合物不起化学反应。(2)因对被提纯的有机物应具有热溶,冷不溶性质。(3)杂质和被提纯物质,应是一个热溶,一个热不溶(4)对要提纯的有机物能在其中形成较整齐的晶体。(5)溶剂的沸点,不宜太低(易损),也不宜太高(难除)。(6)价廉易得无毒。
9、将溶液进行热过滤时,为什么要尽可能减少溶剂的挥发?如何减少其挥发?
答:溶剂挥发多了,会有部分晶体热过滤时析出留在滤纸上和漏斗颈中,造成损失,若用有机溶剂,挥发多了,造成浪费,还污染环境。为此,过滤时漏斗应盖上表面皿(凹面向下),可减少溶剂的挥发。盛溶液的容器,一般用锥形瓶(水溶液除外),也可减少溶剂的挥发。
10、在布氏漏斗中用溶剂洗涤固体时应该注意些什么?
答:用重结晶的同一溶剂进行洗涤,用量应尽量少,以减少溶解损失。如重结晶的溶剂的熔点较高,在用原溶剂至少洗涤一次后。可用低沸点的溶剂洗涤,使最后的结晶产物易于干燥,(要注意此溶剂必须能和第一种溶剂互溶而对晶体是不溶或微溶的。
11、我最近在做一个反应,溶剂中含有一定量的吡啶,后处理方法,蒸干溶剂后加入低极性的溶剂重结晶,但吡啶很难被蒸除,这样就影响了析出。有哪位能提出好的方法?
如果溶剂与水不混溶,那你可以考虑先水洗除去大部分吡啶,然后再蒸除溶剂如果你的溶剂与水混溶,但是产品不溶于水,那你可以考虑蒸溶剂至一定量后,冲入水中,析出产品得到固体,除去大部分吡啶。
12、在处理一个苯环上既有氨基又有羧基的一个芳香化合物时重结晶不好选溶剂!乙醇,甲醇,水,冰乙酸等溶解度都极差,回流条件下也如此,
用盐酸和氨水处理,盐酸成盐酸盐,萃取出不成盐酸盐的杂质,再用氨水成羧酸铵盐,萃取出不成铵盐的杂质,然后调成等电点时在水中析出,应该能较好去杂质。不过氨水成羧酸盐不是很容易。我通常用酸碱倒的方法:加盐酸成盐入水,用有机溶剂(如EA)萃取除去非胺类杂质;再用氢氧化钠调节水相到析出固体,此时pH值通常在1~2 之间,并用EA 溶解该固体(这个就是游离的氨基苯甲酸),水相中残留水溶性和碱溶性杂质。我最近做过的一个氨基苯甲酸衍生物,用上述酸碱倒的方法进行初步的纯化后,点TLC 显示基本是一个点了。然后用乙酸乙酯热溶,强烈搅拌下滴加石油醚并放冷。析出的白色固体抽滤、洗涤。最终产物的HPLC 纯度99%。
13、我的产品是黄色粘稠的,减压蒸馏后沾在烧瓶里,每次重结晶也不知道溶没溶,所以晶体也析不出来!请问大家有没有什么好办法(产品是一种季铵盐)?
不知结构如何?我做过一些杂环季铵盐的化合物,我想你可以用乙腈溶解,后加入乙酸乙酯、丙酮等极性小一点溶剂析出产物,我做的效果很好,希望对你有帮助。我第一个反应的产物是粘稠固体,将反应液倒掉后用丙酮重结晶,能得到很好的晶体。于是我又做了另外一个取代基不一样的结构类似的反应,产物是油状物,同样将反应液倒掉后用丙酮重结晶,析不出固体;用乙醇重结晶,只能析出油状物;于是试了一下丙酮/乙醇混合液,结果要么析出固体很粘,要么没固体析出。不知道各位针对油状物的重结晶有什么高招?我要的化合物极性很小,一般石油醚/乙酸乙酯(10:1)就能跑开。
把油状物用适当适量溶剂溶解,用液氮乙醇降温(50 到60 低温就可)当变混浊时,看有细小颗粒没,没有在慢慢冷却不要心急,不然一下就都成油了,看有细小颗粒,室温静止,细小颗粒能聚到一起逐渐结晶。有晶种那更好,看有细小颗粒,加入晶种,室温静止很快就有结晶了!用石油醚热提的方法应该就可以。
这个石油醚热提-冷却法我也试过了,还是不行,析出来的依然是很油很油的东西。好像我的操作没什么问题呀。用醚溶解,浓缩得差不多了就放着自然挥发干,就得到好的晶体.有好多都可以行得通,可以试试这样比较容易结晶,但是问题是晶型不好而且容易包有杂质。你的化合物的极性比较小,觉得乙醇、甲醇、丙酮都是很好的结晶溶剂。如果产物本身是固体(文献提供),而你用板层或者液相测得产物还比较纯的话,乙醇结晶应该可以的。在重结晶冷却、结晶液变浑浊时,加入晶种(过柱可得),或可快速析出晶体;或者让油状物和乙醇在冰浴下搅拌过夜,说不定第二天有惊喜的发现。
14,油状物结晶情况较复杂,没有一个通用的方法
1、通常,产生油状物是反应控制不好生成的,所以首先是查反应条件是否适合.
2、油状物通常需要经过粗步的去杂再结晶,如活性碳脱色、用不溶的有机溶剂提取了大部分高沸点物质、完全脱去水份等。
3、选择合适的吸咐树脂吸咐提纯,再洗脱、结晶是最灵验的油状物结晶法。
4、溶剂选择有很大的偶然性,但极性很低的产品用正已烷与中等极性的溶剂结晶往往会有意想不到的效果。
15、我的产品是一个羧酸,在甲醇,乙醇,丙酮,等常见溶剂中溶解性都不太好,在DMF 中很好,水中溶解一小部分,而且在水中会变质(可能聚合了),杂质是极性很大的东西(CHCl3/CH3OH=2:1 爬板,杂质仍在原点),不用过柱的方法怎样将其出去那??
羧酸成盐,有机溶剂除去杂质,再调到酸.(经典的“酸碱倒”方法)。
16、我的产品熔点比较的低,三唑并苯环的溴,极性比较的低,几乎只不溶在水,试了很多种重结晶的方法,比如单溶剂,多溶剂等,出来的都是油,高手能否相助,
石油醚最少量室温溶解后,冰箱中冷冻或者干冰中冷冻。乙醇最少量室温溶解,加少许水调节至不析出油状物(若析出,再加少许乙醇复溶),冰箱中冷冻或者干冰中冷冻。我以前的一个样品,25 度熔点,石油醚中易溶,就是这么析出晶体的。
17、高手们,有做过钾盐重结晶的吗?比如用什么溶剂比较好?本人想做LOSANT
AN钾盐的重结晶,试过不少溶剂,可是没有成功有机钾盐的水溶性往往很好,而与大部分的有机溶剂溶解性都很差,用单一的溶剂结晶困难很大,有少量钾盐产品可用甲醇重结晶,钾盐用混合溶剂是不错的选择、常见的搭配是水作为一个相态,另一相态以甲醇、乙醇、异丙醇、丙酮比较合理,乙腈偶然可用,但很易分层,只能针对大倍量结晶用。
18、做有机试验经常要纯化产物或试剂。但是过柱子太麻烦,我经常偷懒用重结晶,
1. 与“相似相溶“背道而驰就行了,大极性的东西,用中等极性的溶剂结晶;小极性的东西,用大极性的溶剂。这样,有一半以上的情况是适合的。
2.先试:石油醚(正己烷)、乙醚、乙酸乙酯、乙醇、水,再试:丙酮、甲醇、乙腈、苯、氯仿、乙酸、啶等。如果还不行,就只好混合了。乙醚可以利用其(1)挥发性;(2)延玻璃向上爬而使固体析出的特性。丙酮如不与水配伍,应加以干燥。
3.混合溶剂法:用过量热的良溶剂溶解,过滤,加热,缓慢加入不良溶剂至有浑浊,加热至澄清。静置等待。。。
4.用分级结晶法。转自:漫游药化






